|
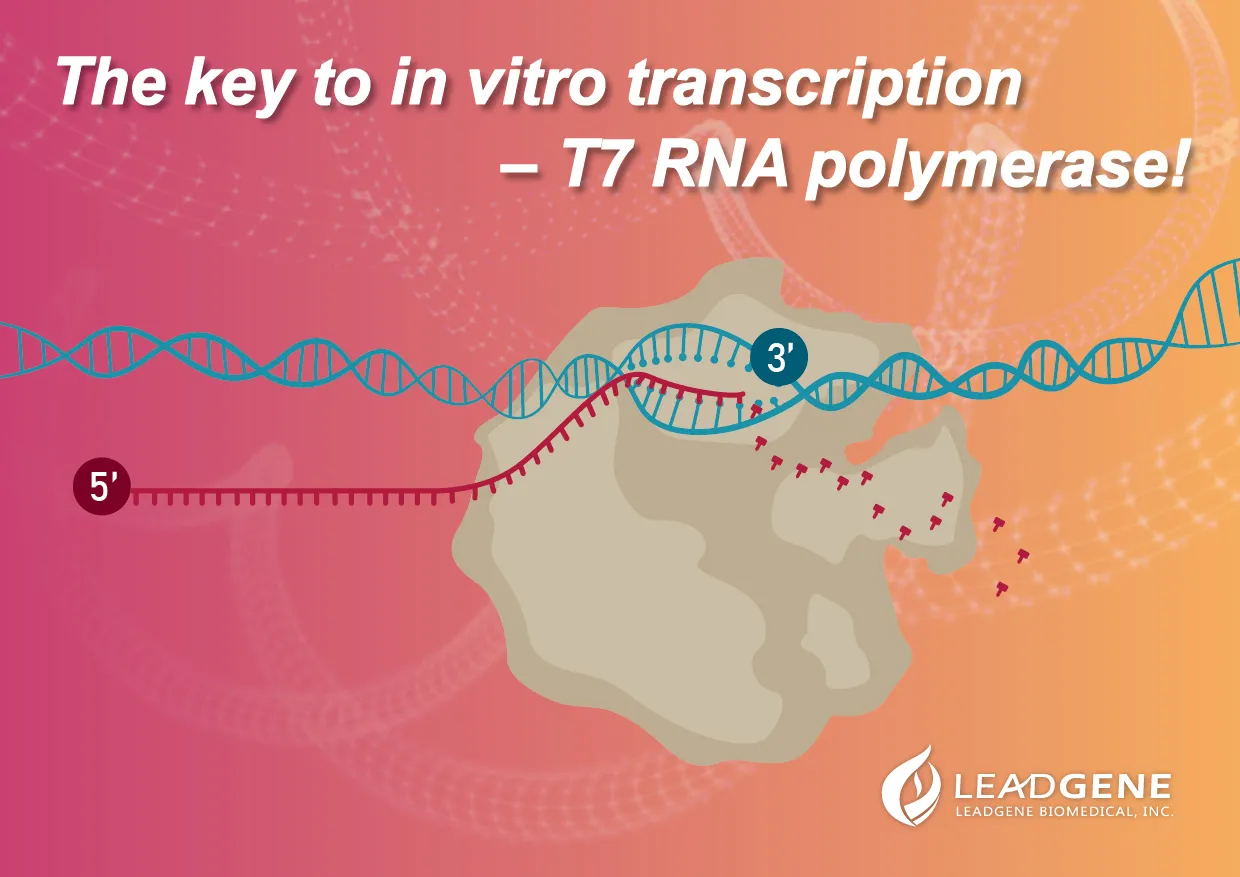
體外轉錄反應 (In vitro transcription, IVT) |
在生物體內,攜帶遺傳物質的DNA會藉由胞內酵素與相關蛋白質將DNA轉錄為RNA,並進一步轉譯為蛋白質,作為生物體的工具,參與個體各種代謝與生合成反應。隨著分子生物學的蓬勃發展,轉錄作用也可於胞外進行,利用已經設計好的DNA片段作為模板,同時加入RNA聚合酶、NTPs、RNAase inhibitors等原料,就可以在胞外順利轉錄RNA片段,再經過五端加帽、三端加尾的修飾,便能產生穩定之RNA。
|
體外轉錄反應的應用 |
許多分子診斷方法與分子生物學的研究都牽涉到體外轉錄反應,轉錄而產生的RNA也可應用於基因編輯、RNA干擾等多種用途,以下將介紹幾種應用:
- mRNA疫苗
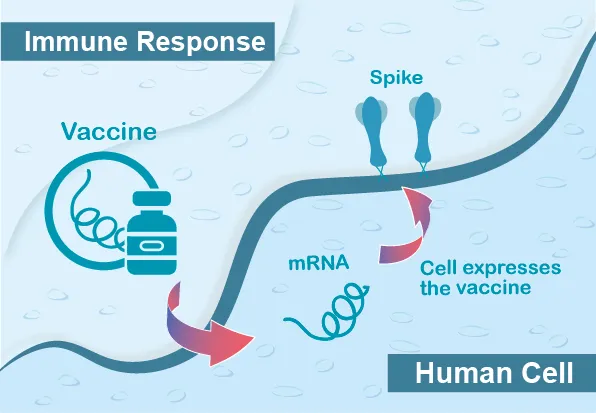
mRNA疫苗設計是將能表達病毒表面抗原蛋白的messenger RNA (mRNA),以lipid nanoparticles (LNPs)包裹,施打至人體肌肉中;mRNA在肌肉細胞中進一步轉譯、製造出病毒蛋白,模擬病毒感染時所遇到病毒蛋白的情況,而引發免疫反應。
mRNA較為脆弱、容易被核糖核酸酶降解,因此mRNA合成的品質與穩定性成為應用的關鍵。mRNA的穩定與否則與五端加帽、三端加尾、非轉譯區的結構有關,近年來RNA研究與技術突飛猛進,並且已發展LNPs使mRNA可順利通過細胞膜,使mRNA能成功開發並上市。
相較於傳統疫苗,mRNA疫苗在製造上具備安全與快速的優勢。mRNA疫苗在製程過程中不涉及感染性病原體,mRNA本身亦不具有感染性,因此可大幅降低疫苗製造環境的生物安全等級,有利於疫苗製造。並且mRNA合成快速,便於進行修飾,一旦選定抗原標的,即可快速製造疫苗,不必像傳統疫苗須經過細胞培養、濃縮純化等費工費時的步驟,大大縮短疫苗製程時間。
- 核酸適體(aptamer)合成
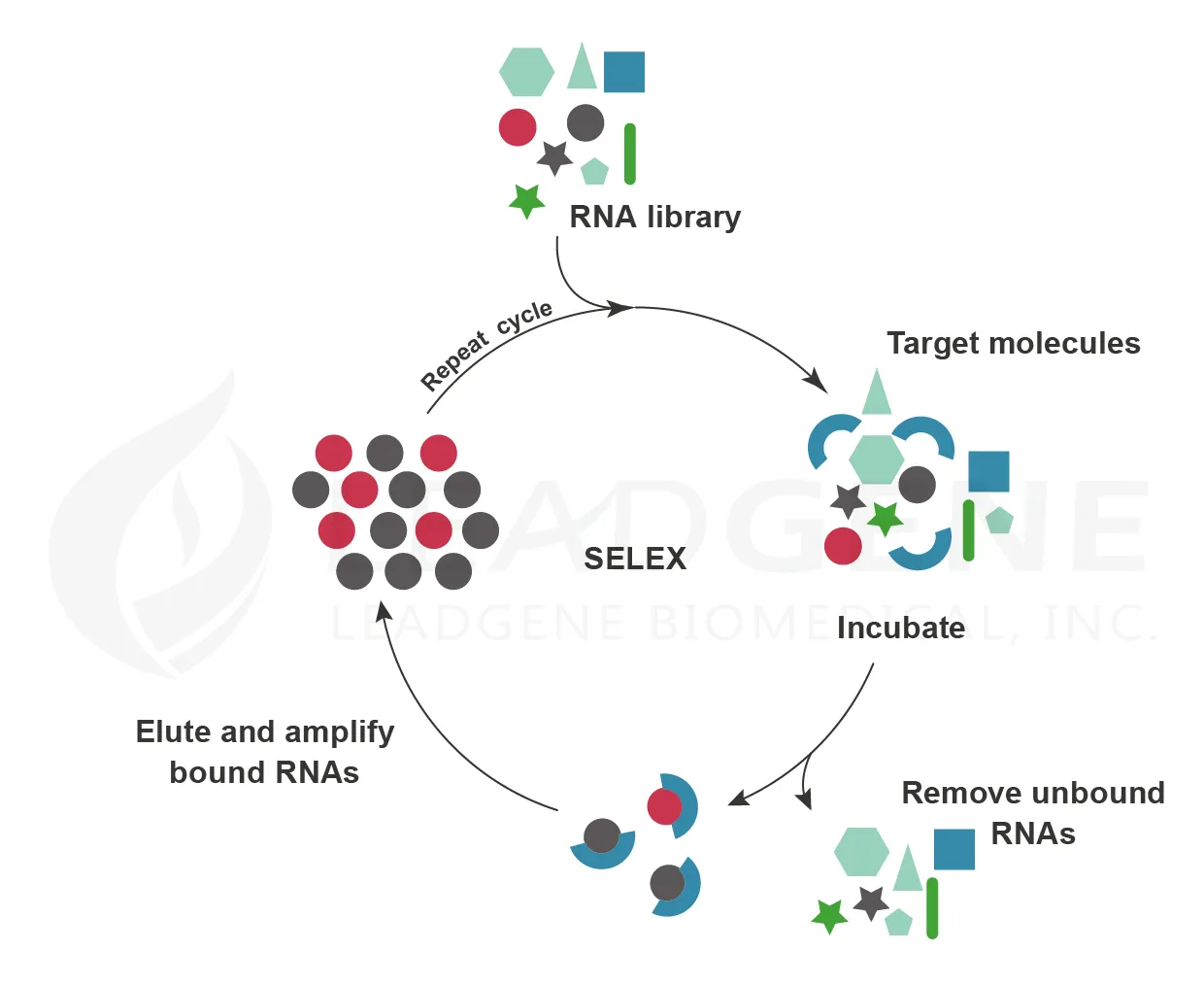
Sidney Altman與Thomas Cech於1989年發現小分子RNA/DNA具有與配體結合及催化等功能,而1992年Larry Gold與Craig Tuerk發展SELEX技術 (systematic evolution of ligands by exponential enrichment),藉此篩選小分子RNA或單鏈DNA與標的結合,此小分子RNA即為核酸適體 (Aptamer)。核酸適體以3D結構的構型互補模式 (shape complementarity) 與配體蛋白結合,兼具高特異性與高親和力的特性。又核酸適體可廣泛應用於多種物質,包含離子、小分子化合物、蛋白質、核酸、病毒、細菌、細胞等,比起抗體,核酸適體對酸鹼及熱也都較穩定,因此核酸適體可作為功能與抗體類似的分子工具。目前市場上獲得 FDA 核准的適體藥物為 Macugen (Pegaptanib),它能針對血管內皮生長因子(VEGF),用於治療新生血管型老年性黃斑部病變。近年來受惠於RNA合成技術成熟,合成成本下降,因此核酸適體亦成為新藥開發與小分子藥物研究的新方向。
- 基因編輯
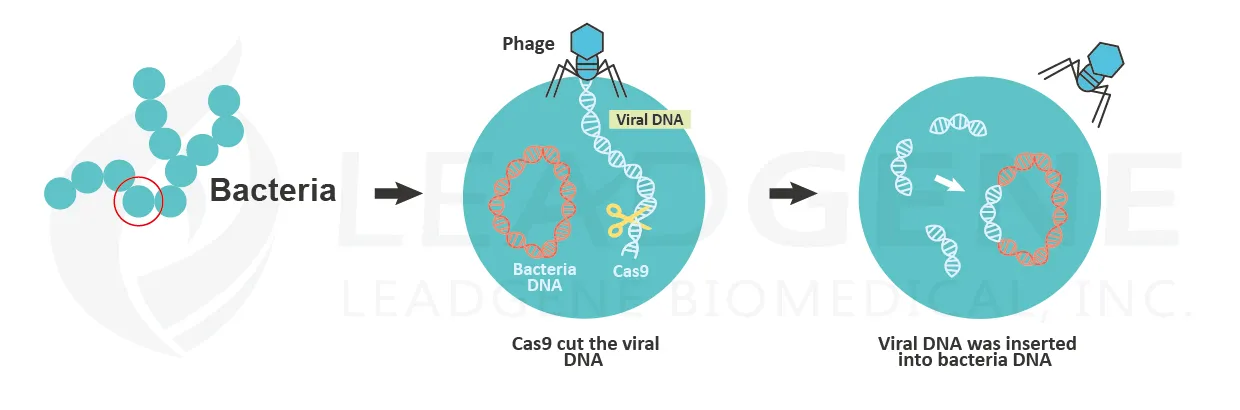
Emmanuelle Charpentier與Jennifer Doudna因發現CRISPR/Cas9,對於基因編輯有重大貢獻,而榮獲2020年諾貝爾化學獎桂冠。基因編輯的發現可以追朔至1987年,當時日本科學家在大腸桿菌的基因體中發現規律重複之DNA迴文序列(palindrome),且每個重複之間又有長度相同之間隔,科學家將當時的發現命名為CRISPR (clustered, regularly interspaced, short palindromic repeats)。後來的研究發現,許多細菌體內皆存在CRISPR的機制,目的是用來防禦噬菌體感染。當病毒感染細菌後,存活下來的細菌會將病毒的DNA片段插入自己的CRISPR序列中,當未來再次被病毒感染時,CRISPR序列便轉錄出與病毒序列互補之RNA,一旦當病毒的DNA被CRISPR RNA辨識後,細菌的Cas9 酵素便能精準切除病毒DNA,使病毒失去活性。
CRISPR 系統是作用於細菌的單細胞生物體內,在真核生物的應用上仍有許多瓶頸有待克服,其中最大的阻礙是真核生物的基因體過於龐大;Cas9 所辨認的序列是23個鹼基,但人體基因體有65億個鹼基,因此Cas9在人體內的剪輯並非百分之百正確。除此之外,CRISPR系統只負責剪下DNA片段,而斷裂的DNA得依靠細胞DNA修補機制自行填補正確的片段。真核生物中,雙股斷裂DNA修補有兩種機制,分別為同源基因引導修復 (Homology-directed repair, HDR)與非同源性末端接合 (Nonhomologous end-joining, NHEJ)。HDR為較精準的DNA修補,會在DNA缺口附近尋找合適的模板進行複製後插入;而NHEJ則是直接把斷裂的缺口接起來。細胞多半利用NHEJ機制進行雙股斷裂之DNA修補,因此基因在經過CRISPR剪切後,可能會使DNA造成不必要的缺失或插入錯誤片段。DNA修復的不確定性也是基因編輯困難且具爭議的原因,目前基因編輯主要做法傾向將免疫細胞在人體取出後,在體外進行編輯後,放回病患體內進行免疫治療。
- RNA干擾 (RNA interference, RNAi)
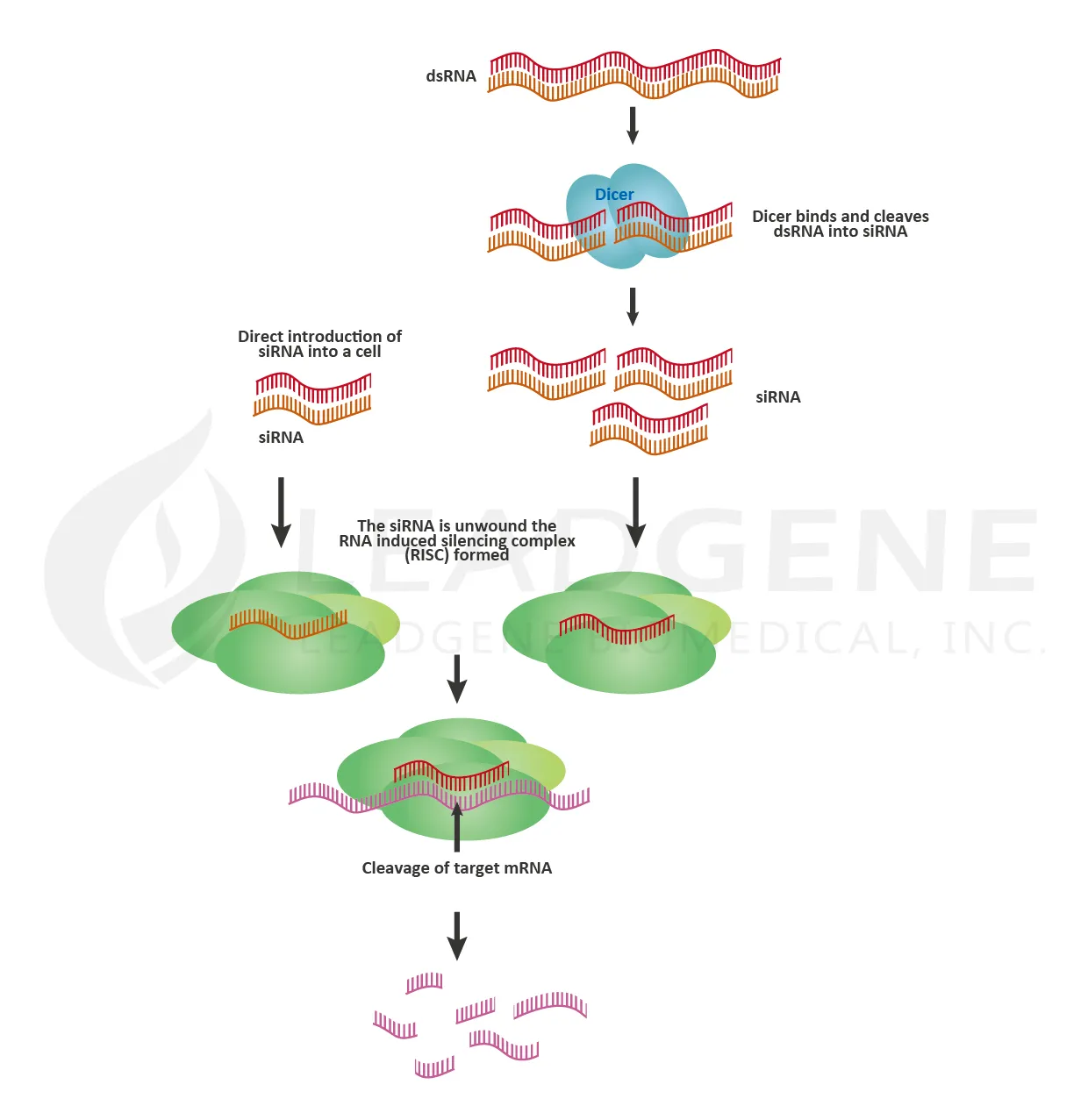
RNAi是一種高效率且專一性高、可使基因沉默 (gene silencing)之機轉,在生物學上應用廣泛於RNA藥物開發、生物途徑與訊息傳遞研究或疾病基因分析等領域。RNAi是利用小分子核糖核酸 (microRNA, miRNA)或小分子干擾核糖核酸 (small interfering RNA, siRNA)作為主要的干擾形式,旨在藉由雙鏈RNA與mRNA序列互補後結合,而導致mRNA降解,最終成功抑制特定基因轉譯,達到抑制目標蛋白表現的效果。
近年來隨著生物資訊學、奈米技術等研究領域發展,lipid nanoparticles (LNPs)技術也漸趨成熟,可以克服帶電RNA不易進入細胞的困難,因此利用RNAi技術做為RNA 藥物開發也逐漸發光發熱。小分子藥物或抗體藥經常面臨結構複雜、分子量龐大或藥物結合問題,相較之下,RNA藥物是利用RNA互補的特性,沒有二次代謝產物,可更精準與更有效率達到治療效果。並且RNA藥物成分相對單純,RNA易於快速改變序列,方便進行個人化治療或因應病原體突變的能力。目前Onpattro (Patisiran)已於2018成為第一個獲得 FDA 核准的RNAi藥物,用於治療成人遺傳性轉甲狀腺素介導的類澱粉變性 (hereditary transthyretin-mediated amyloidosis, hATTR)引起的多發性神經病變;2019年FDA則核准Givlaari (Givosiran)藥物,用於治療成人急性肝性紫質症(acute hepatic porphyria)。
- RNA病毒之RNA製造
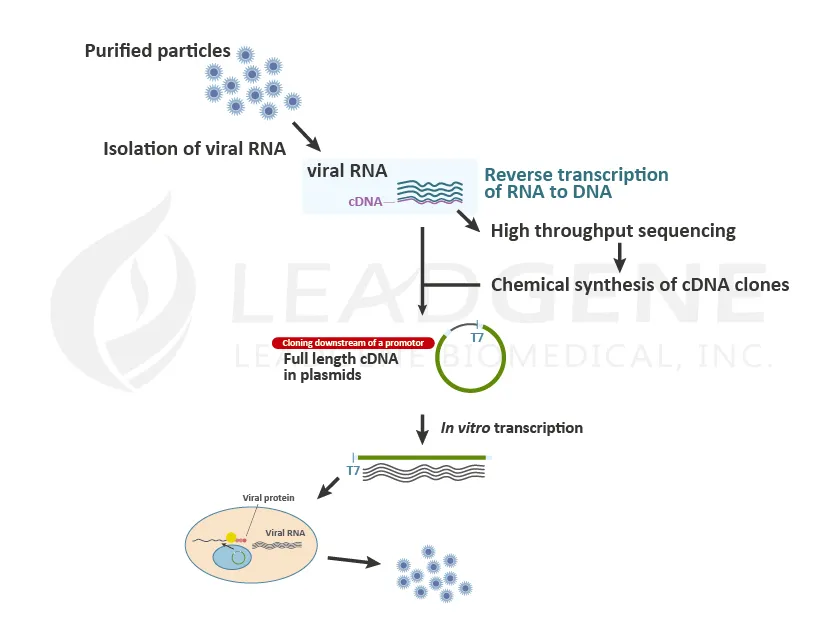
RNA病毒進入宿主細胞後,會釋放病毒遺傳物質RNA,並且綁架宿主細胞正常功能,使細胞開始複製病毒基因並合成病毒蛋白。科學家利用體外轉錄製造病毒RNA,再將病毒RNA送入細胞藉此模擬病毒感染,此方法可用於病毒感染實驗,或是大量培養病毒以作為減毒/滅活疫苗;由於體外轉錄相對簡易,科學家亦利用克隆實驗,設計或刻意製造突變位點於DNA模板,使特定的RNA片段能於體外順利轉錄,製造出基因重組之RNA病毒。
|
偉喬生醫提供穩定且高產率之T7 RNA聚合酶,對T7 promotor具有高度專一性,催化DNA轉錄為RNA,並提供多種體外轉錄相關試劑。 |
