|
奈米抗體的發現 |
奈米抗體(Nanobody,Nb),又稱單域抗體(sdAb)、或駱駝抗體,是一種源自駱駝科動物(如駱駝、羊駝等)的獨特抗體分子。這種抗體於1993年首次被比利時科學家發現,當時他們在駱駝血清樣本中找到出一種僅由重鏈組成的抗體,稱為重鏈抗體(heavy-chain only antibody,簡稱HCAb)。這些重鏈抗體的分子量約為90 kDa,結構上其恆定區包含由雙硫鍵連接,一般所認知的可結晶片段 (crystallizable fragment, Fc) :鉸鏈區、重鍊恆定區CH2與CH3之二聚體;以及兩個重鍊抗體的可變區(VHH, VH domain of a HCAb),奈米抗體便是從這種重鏈抗體中提取的可變區單元,如圖一所示。
|
奈米抗體的結構特徵 |
奈米抗體有別於單鏈可變區域 (single-chain variable fragment, scFv) 的結構,僅由單個VHH組成,沒有輕鏈結構,因此也不需要重鍊與輕鍊之間的連接子(linker)短胜肽。分子量僅為15 kDa,相當於傳統抗體的十分之一,如圖一所示。
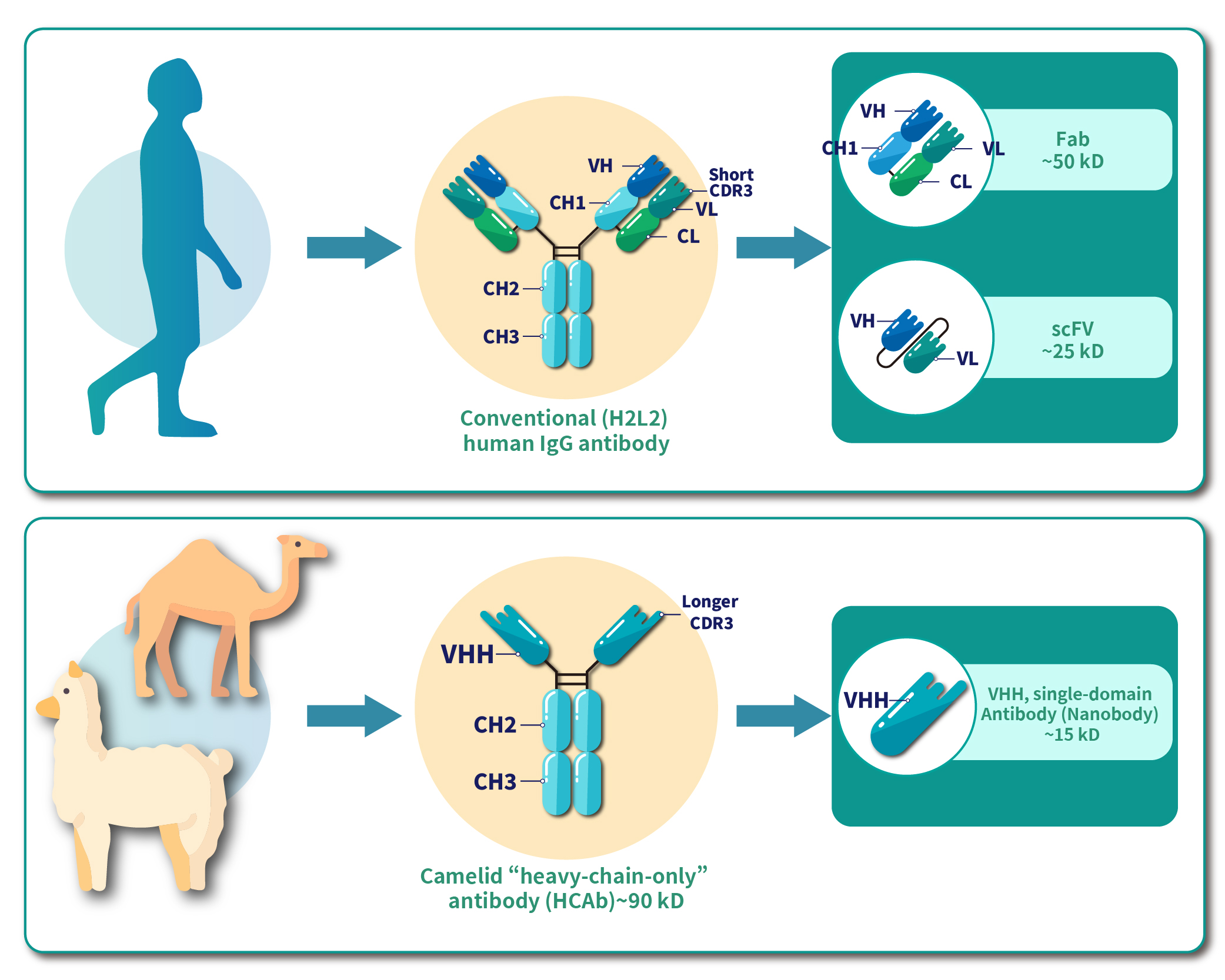
圖一:傳統IgG抗體、駱駝科抗體與奈米抗體的結構差異
在奈米抗體 VHH 與傳統抗體 VH 區域的共同結構中,除了保守的框架區域(FR1、FR2、FR3 和 FR4)與互補決定位區(CDR1、CDR2 和 CDR3)外,二者之間還存在顯著差異。傳統抗體的 VH 區域在 FR2 中包含四個高度保守的疏水性胺基酸(V37、G44、L45 和 W47),而奈米抗體則將這些殘基替換為親水性胺基酸(F37、E44、R45 和 G47),顯著提升了其溶解性。此外,奈米抗體的 CDR1 和 CDR3 區域通常比 VH 區域略長,這使其更能有效靶向隱藏於複雜三維結構中的抗原表位,例如酵素的催化活性點及病毒的受體結合位點。由於奈米抗體具有獨特的結構和生化性質,能精準地識別並結合這些表位,因此在疾病診斷和治療中的應用潛力大大提升,如圖二所示。
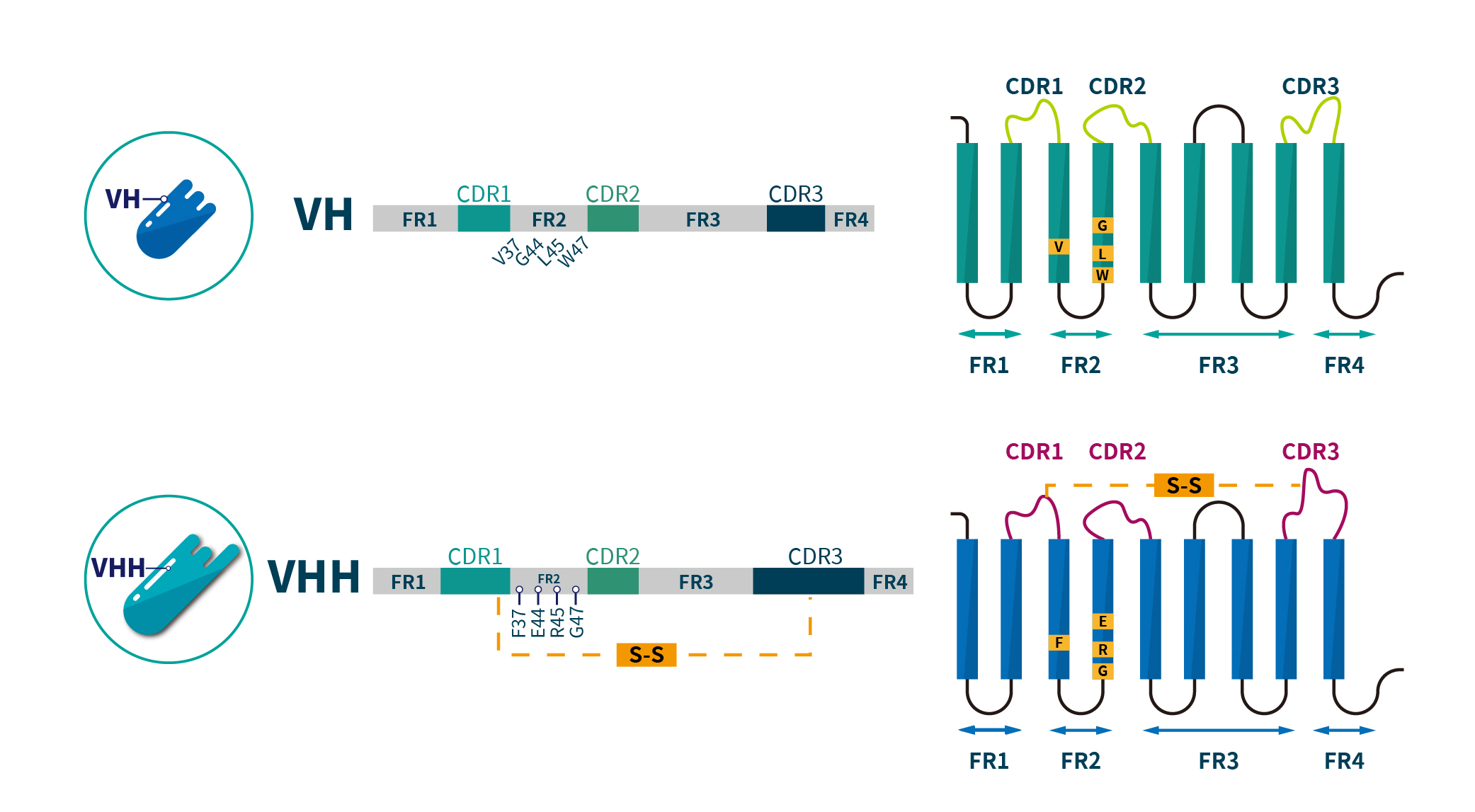
圖二:傳統 IgG 抗體的 VH 區域與駱駝科 VHH 區域的結構差異
|
奈米抗體的優勢與挑戰 |
奈米抗體(VHH抗體)的獨特結構賦予其在生物醫學領域的多項優勢,但同時也面臨一些挑戰。
優勢:
- 結構簡單,易於表達與開發:奈米抗體僅由單個可變重鏈區(VHH)組成,沒有輕鏈,這使其能夠在不同的表達系統中高效生產,例如大腸桿菌或酵母
- 高穩定性與強親和力:奈米抗體能夠在極端的pH值、溫度和蛋白酶消化條件下保持穩定,並且能夠以極高的親和力結合目標抗原
- 高靶向能力與組織穿透力:奈米抗體的體積小,使其能夠深入組織,甚至穿透腫瘤微環境,這在靶向腫瘤細胞時非常有利
- 低免疫原性與易於人源化:由於奈米抗體來源於駱駝科動物,其在人體內的免疫原性較低,並且易於進行人源化處理,提升了其臨床應用的安全性
挑戰:
- 短半衰期:由於奈米抗體分子量小,其半衰期相對較短,這可能會限制其在某些臨床應用中的效力。然而,這一問題可以通過與抗血清白蛋白或Fc段融合來延長半衰期。奈米抗體因其卓越的特性,如表一所示,正成為癌症診斷和治療中的有力工具。但未來仍需克服其應用中的一些技術挑戰。
表一:奈米抗體VHH和一般傳統抗體特性比較
|
|
奈米抗體的類型 |
根據不同的特性和應用,奈米抗體可以分為以下幾種類型:
1. 天然型奈米抗體(Natural Nanobody):
這些奈米抗體直接從駱駝科動物(如駱駝、羊駝等)的重鏈抗體中提取。這類奈米抗體保留了天然抗體的結構和功能,並具有高度的穩定性和低免疫原性。
2. 工程化奈米抗體(Engineered Nanobody)
工程化奈米抗體是通過基因工程技術對天然奈米抗體進行改造以改進其特性。例如,科學家可以對奈米抗體的結構進行優化,使其具有更高的親和力、更好的穩定性或針對特定抗原的專一性。這類奈米抗體通常用于更具挑戰性的生物醫學應用,如癌症治療和精確診斷。
3. 多價奈米抗體(Multivalent Nanobody)
多價奈米抗體是將多個奈米抗體結合在一起形成的復合物,這種結構使其能夠同時結合多個抗原或多個抗原表位。多價奈米抗體可以增加與目標抗原的結合強度,提高療效,並減少抗體逃逸現象,這在癌症免疫治療中尤其有用。
4. 雙特異性奈米抗體(Bispecific Nanobody)
雙特異性奈米抗體是結合了兩個不同特異性的奈米抗體片段,能夠同時識別並結合兩個不同的抗原或抗原表位。這類奈米抗體在癌症治療和其他復雜疾病的治療中具有潛在優勢,因為它們能夠同時攻擊多個病灶或調節多條信號通路。
5. 奈米抗體融合蛋白(Nanobody-protein fusion)
融合奈米抗體是將奈米抗體與其他功能性分子(如酵素、藥物、或其他治療蛋白)融合在一起,形成具有多種功能的複合分子。這種奈米抗體可以結合靶向作用和治療效應於一體,用於定點治療、精確遞送藥物或增強免疫應答。
6. 奈米抗體藥物偶聯物(Nanobody-Drug Conjugate, NDC)
奈米抗體藥物偶聯物是將奈米抗體與細胞毒性藥物偶聯形成的復合物,這類奈米抗體能夠精確識別和結合癌細胞,並將毒性藥物直接送入癌細胞內部,從而實現精確殺傷腫瘤細胞的目的,同時最大限度地減少對正常細胞的損害。
這些類型的奈米抗體在生物醫學研究、診斷和治療中有著廣泛的應用潛力,如圖三所示。並且隨著技術的不斷進步,將可能開發出更多新的奈米抗體類型。
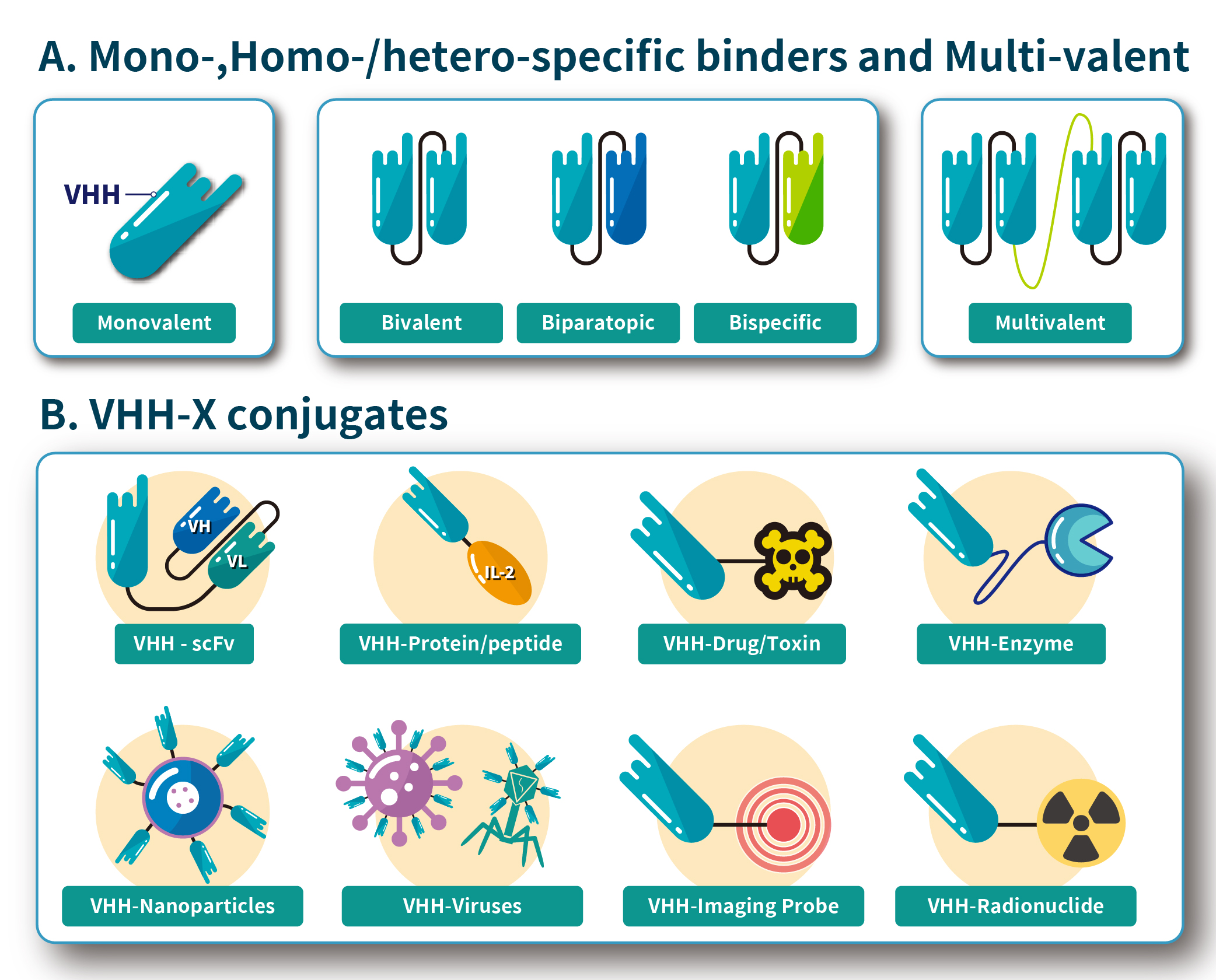
圖三:奈米抗體的基本結構及可應用類型
|
奈米抗體在臨床上的應用 |
根據其卓越的性能,奈米抗體已被廣泛應用於分子成像與診斷、藥物遞送、腫瘤免疫治療、細胞療法等研究領域。值得注意的是,奈米抗體在中樞神經系統、循環系統疾病、腫瘤以及傳染性和炎症性疾病中的應用展示出了極大的價值與前景。特別是在腫瘤治療領域,各種治療劑如雙特異性奈米抗體、奈米抗體藥物偶聯物(NDC)、CAR-T、CAR-NK及靶向放射性核素已經被開發出來。這些治療方法的持續研究和開發為患者帶來了新的希望。
截至2023年7月,全球已有至少四種奈米抗體藥物獲批上市。由Ablynx開發的Caplacizumab(商品名Cablivi®)是全球首個奈米抗體藥物,適用於治療成人獲得性血栓性血小板減少性紫癜(aTTP);該藥物於2018年8月31日獲歐洲藥品管理局批准上市。傳奇生物科技公司開發的CAR-T細胞產品CARVYKTI(通用名Ciltacabtagene Autoleucel)是一種獨特的雙價奈米抗體設計,也是首個獲FDA批准的基於VHH的CAR-T療法產品,應用於復發或難治性多發性骨髓瘤的治療。另一款由Ablynx開發的奈米抗體藥物Ozoralizumab是一種人源化的三價雙特異性奈米抗體,包含兩個抗人類TNF-α奈米抗體和一個抗人類血清白蛋白奈米抗體,該藥物於2022年9月26日在日本獲批上市。由康寧傑瑞開發的Envafolimab,屬於PD-L1單域抗體Fc融合蛋白,於2021年11月在中國獲批上市,如圖四,表二所示。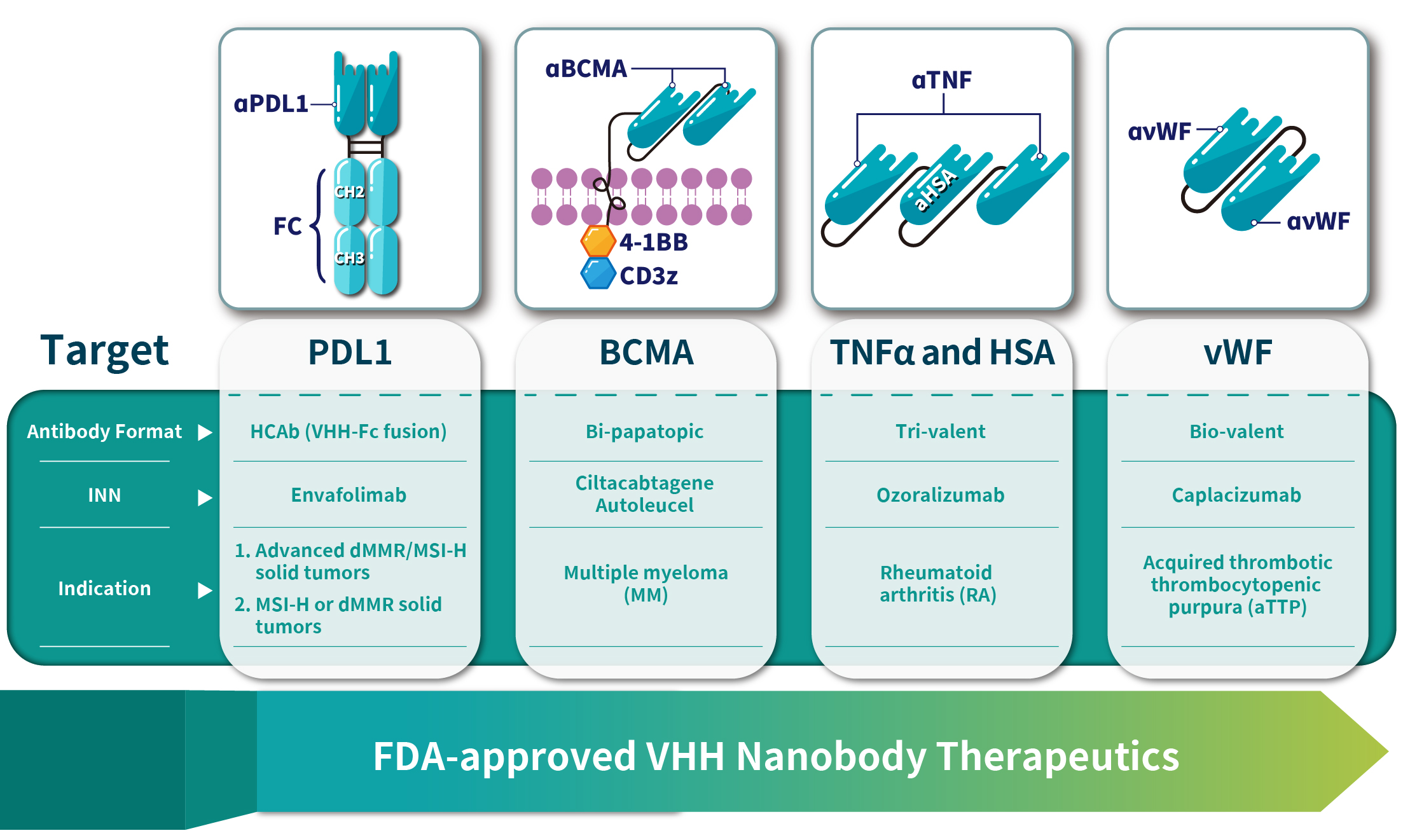 圖四:成功上市的四種奈米抗體藥物
圖四:成功上市的四種奈米抗體藥物
表二:已獲准上市的奈米抗體藥物
|
此外,目前已有超過20種奈米抗體相關藥物進入臨床階段。根據最新的臨床研究進展,下列表格三詳細列出了多種奈米抗體藥物的臨床試驗階段與適應症。這些奈米抗體藥物涵蓋了從固體腫瘤到自體炎症性疾病,從血液病到免疫失調性疾病的廣泛應用,進一步顯示了奈米抗體在醫療領域的巨大潛力。隨著臨床研究的不斷深入,更多奈米抗體藥物預計將進一步推動相關治療方法的發展,為患者帶來更大的治療機會和希望。
表三:臨床試驗中的奈米抗體藥物
|
奈米抗體除了在藥物治療上發揮了重要作用,在醫學診斷與研究應用也扮演重要角色。奈米抗體可用於標記放射性同位素或螢光染料,特別是分子影像學,以幫助醫生精確定位腫瘤或炎症部位。此外,奈米抗體還被用於開發高特異性和穩定性的生物感測器,用於快速檢測疾病標誌物。
隨著技術的不斷進步,奈米抗體的應用範圍將進一步擴大。在治療性抗體領域,VHH抗體有望成為新一代靶向治療工具,特別是在癌症和炎症性疾病的治療中。其高特異性、低免疫原性和深度組織穿透能力,使其成為未來治療和診斷領域中的一個重要方向。
|
VHH全球市場規模 |
VHH抗體因其獨特的生物學特性和廣泛的應用前景,目前為生物製藥領域的重要創新工具。
根據市場研究報告,2021年全球VHH抗體市場規模約為6億美元,預計到2026年將增長至20億美元,複合年增長率(CAGR)約為25%。這反映了對VHH抗體在藥物開發、診斷試劑和研究工具等多方面需求的快速增長。再加上多家生物技術公司在VHH抗體領域的投資和併購活動顯示了其潛在的高經濟價值。像是在VHH抗體領域的領導者Ablynx公司被Sanofi以39億歐元收購,顯示著VHH抗體技術的高商業價值。其中在全球市場上第一個獲得FDA批准的VHH抗體藥物Caplacizumab(Cablivi),目前在全球市場上的表現優異,其銷售收入是目前衡量VHH抗體經濟價值的重要指標之一。
隨著更多VHH抗體藥物進入臨床試驗階段,並可能獲得監管批准,未來VHH抗體市場有望繼續擴大。總體而言,VHH抗體因其獨特的優勢在全球生物製藥市場中佔據了重要地位,預計未來幾年將繼續保持快速增長,為全球經濟帶來顯著的經濟價值。
|
技術服務連結 |
|
參考文獻 |
- Hamers-Casterman, C., Desmyter, A., Maes, E., Verbrugghe, A., Hamers, R., Songa, E. B., ... & Muyldermans, S. (1993). Naturally occurring antibodies devoid of light chains. Nature, 363(6428), 446–448.
- Harmsen, M. M., & De Haard, H. J. (2007). Properties, production, and applications of camelid single-domain antibody fragments. Applied Microbiology and Biotechnology, 77(1), 13–22.
- Lauwereys, M., Arbabi Ghahroudi, M., Desmyter, A., Kinne, J., Holzer, W., De Genst, E., ... & Muyldermans, S. (1998). Potent enzyme inhibitors derived from dromedary heavy-chain antibodies. EMBO Journal, 17(13), 3512–3520.
- Muyldermans, S. (2013). Nanobodies: Natural single-domain antibodies. Annual Review of Biochemistry, 82, 775–797.
- Vincke, C., Loris, R., Saerens, D., Martinez-Rodriguez, S., Muyldermans, S., & Conrath, K. (2012). General strategy to humanize a camelid single-domain antibody and identification of a universal humanized nanobody scaffold. Journal of Biological Chemistry, 287(10), 7346–7355.
- Wesolowski, J., Alzogaray, V., Reyelt, J., Unger, M., Juarez, K., Urrutia, M., ... & Steindl, F. (2009). Single-domain antibodies: Promising experimental and therapeutic tools in infection and immunity. Medical Microbiology and Immunology, 198, 157–174.
- Wesolowski, J., Jain, N., & Scheid, P. (2009). Single-domain antibodies: Promises and challenges of their clinical development. Expert Opinion on Biological Therapy, 9(8), 109–117.
