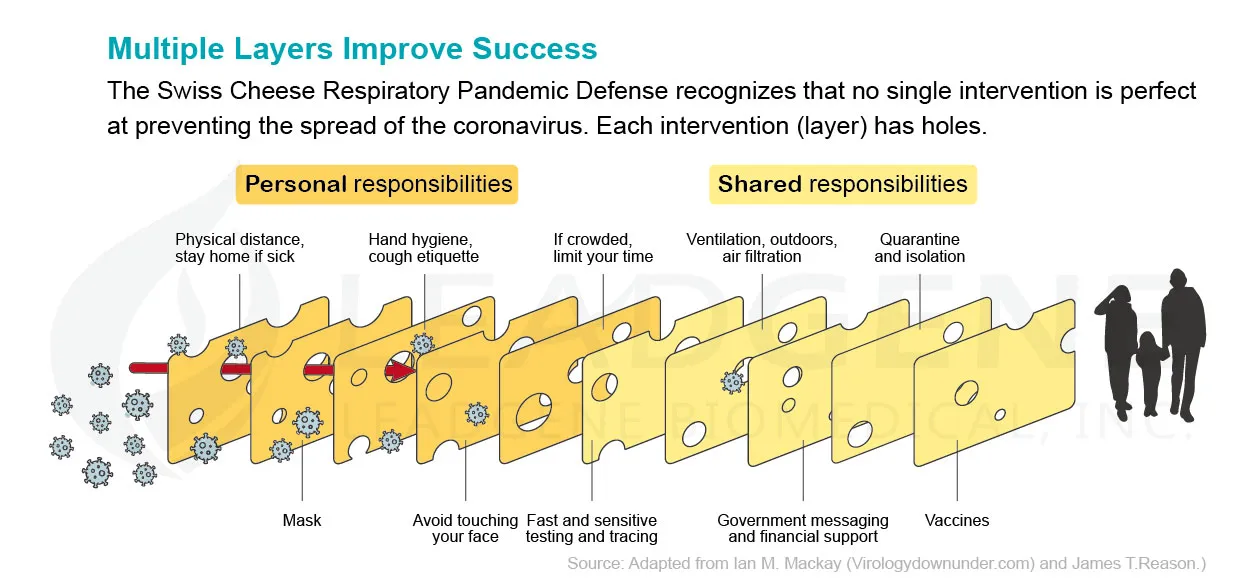
世界正迎向由 Omicron 變體驅動的第四次 COVID 浪潮,即使在那些疫苗接種率高的國家也是如此。新發現的變種輕易地了逃脫宿主從過去感染或兩次疫苗注射中獲得的免疫力,提醒了人們想脫離疫情傳播仍遙遙無期。儘管如此,一些專家在瞭解到 Omicron 變體的高傳染性和低毒力後似窺見了一線希望。由於此流行病學和臨床特徵,當人口中有足夠多的人從正在演化轉弱為區域性流行病的變體中恢復過來時,就可望實現群體免疫。為了將上述期望轉化為現實方案,除了提供應對 COVID-19 的研發材料外,我們對採自醫療和公共衛生機構的信息進行分類,以指陳社交媒體或網站上的猜測和假設,從而破除迷思。
|
這個變種病毒株從何而來? |
討論 Omicron變異株的起源有兩個角度,它的重要性超越了單從病毒學的學術層面關注的問題。釐清是何種因素決定了這種高度傳播變異的出現,有助於科學家了解新變異出現的風險並設法將其降到最低。地理上,這種變異首先在 2021 年 11 月 11 日在博茨瓦納和 2021 年 11 月 14 日在南非採集的樣本中被發現。
跨學科調查一直在研究免疫系統缺損的個體,在刺激病毒突變和新變種出現方面的作用。一些免疫功能低下的患者據信會發展為慢性感染;病毒會在它們的體內停留長達數月或更久的時間,積累數十個胺基酸變化,從而產生更危險的後代。儘管如此,這並不意味著零號病人一定在南非。使用測序數據監測比較所有病毒變體,包括歐洲國家在內的幾個國家已經確定了早於南非宣布發現Omicron的病例。
基於闡明為何新變種病毒會出現的不懈努力,病毒學家提出,僅僅研究人類身上發生的事情不足以深入了解大流行的起源。最近涉及「反向人畜共患病」一詞的假設表明,Omicron的祖先已經從人類傳播到其他動物宿主,可能是囓齒動物和水貂,然後又跳回人類。在這個軌跡中,病毒可以跨物種變異,適應免疫壓力,並在受感染的動物種群中演化成Omicron。這種進化路線似乎更合理,因為動物宿主可以解釋為什麼Omicron的基因組包含人類以前罕見的一系列不尋常的突變,並且大多數人都同意SARS-CoV-2來自東南亞的蝙蝠或穿山甲。推測Omicron出現的兩個理論模型重申了需要系統性方法來尋求更好的抗病毒藥物,以預防或治療免疫系統受損人群的持續感染,並監測與我們共享生存居住空間的野生動物中,病原微生物的傳播。
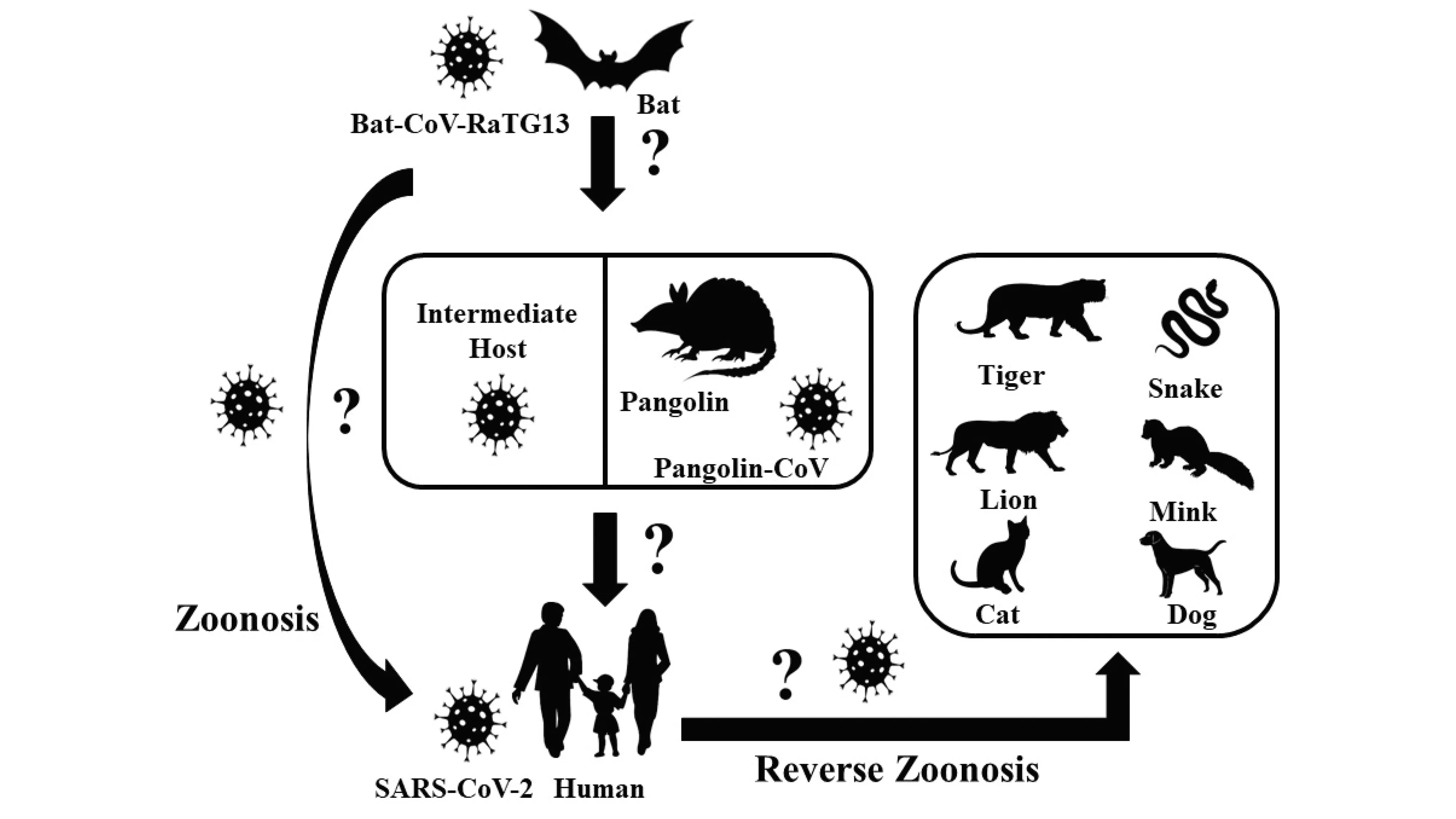
Source: Uddab Poudel, et al., Open Veterinary Journal, 2020.
|
為何核准使用中的疫苗不能有效地防止Omicron變種病毒擴散? |
Omicron 變體正在推動病例數創歷史新高,並使醫院滿負荷運轉,而冬季的突破性感染流引發了對 COVID-19 疫苗功效的懷疑。然而,真實世界的數據顯示,疫苗對防範嚴重疾病和住院治療的有效性超過80%。 目前針對刺突蛋白的 SARS-CoV-2 疫苗是朝著開發抗病毒療法和下一代疫苗邁出的決定性的第一步。隨著 SARS-CoV-2 病毒的迅速進化,研究人員渴望評估在下一代疫苗設計中使用多種刺突蛋白變體或病毒抗原組合的可行性。
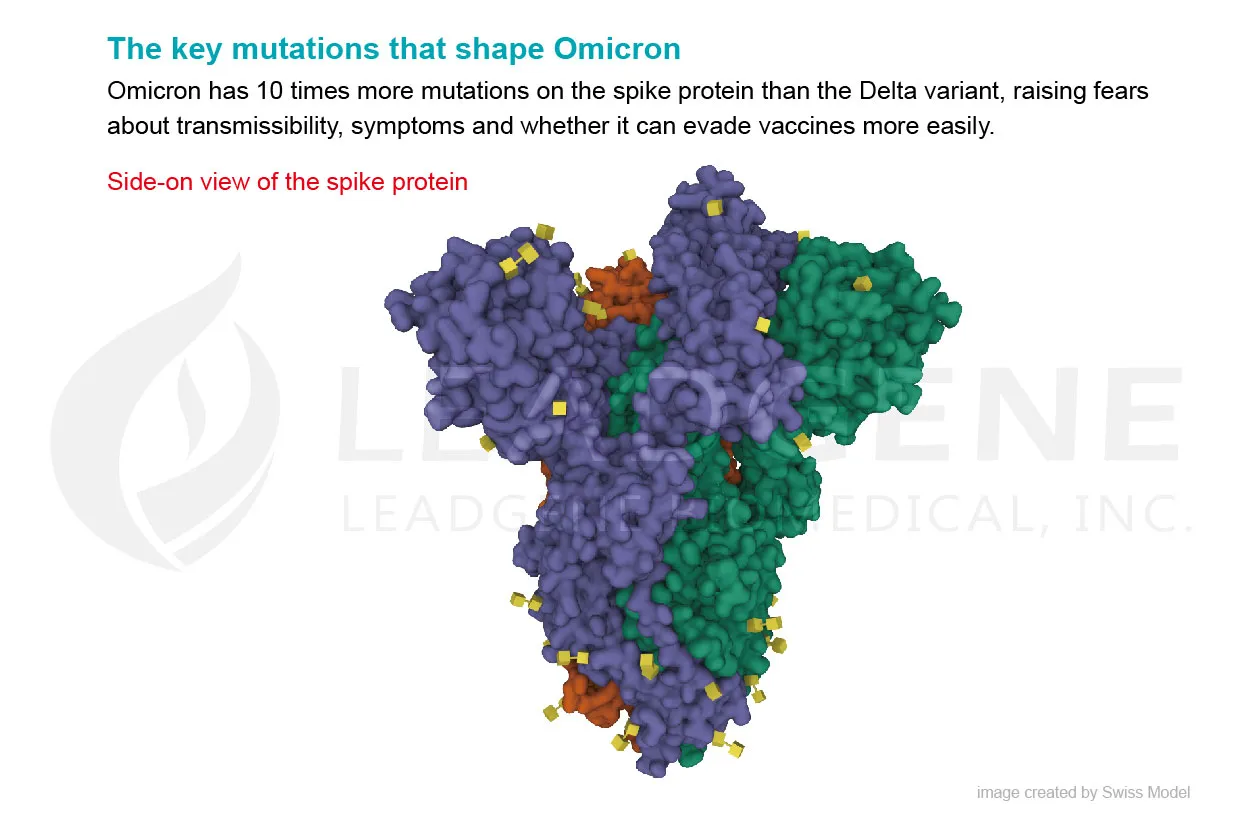
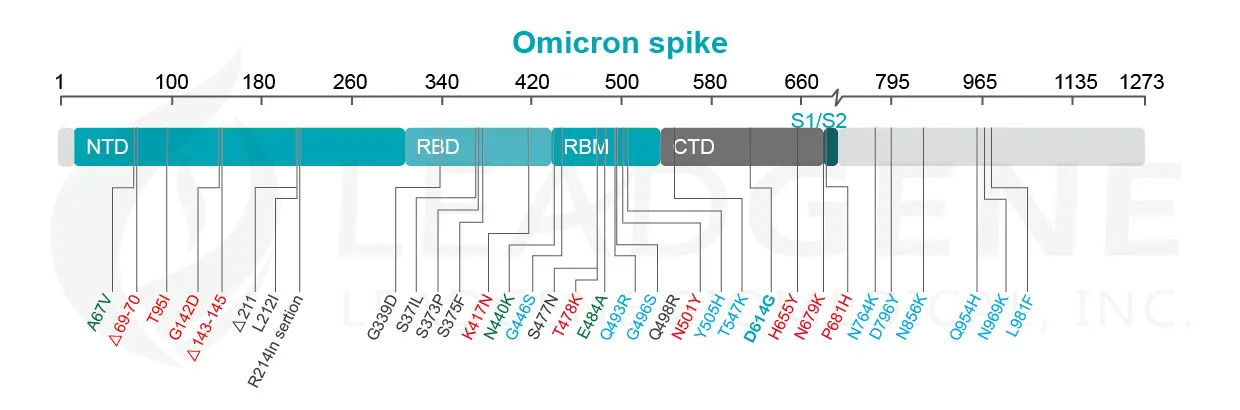
Omicron 在結構上與其他所有已檢驗特徵的變體不同,與野生型武漢-Hu-1 病毒株相比,50 個突變中有 32 個位於刺突蛋白上。最近的研究已經開始闡明高度突變病毒的哪些特徵使其能夠逃避免疫防禦,以逃避恢復期或接種疫苗個體的抗體反應。許多這些突變或缺失會影響刺突蛋白的 N 末端結構域 (NTD) 和受體結合結構域 (RBD),這可能會增加與 ACE2 的結合,同時逃避抗體辨認。在免疫監視的選擇壓力下,關鍵序列改變賦予新興變體適應性優勢。例如,A67V、T95I 和 G142D 改變了 NTD 的局部構型,可能會破壞 NTD 靶向抗體的結合。類似地,已發現胺基酸 241-243 和 246-252 的缺失會影響具有高傳播率的病毒株中 NTD 環的網絡。 SARS-CoV-2 RBD 在殘基 475 和 485 之間有一個高度靈活的區域,其中 S477 位顯示出最高的靈活性。據報導,S477N 和 T478K 的雙重突變不僅會增加與人類 ACE2 的結合,還會影響整體蛋白質表達水平,提高病毒產量和傳染性,儘管它不會對抗體結合造成問題。
在 RBD 中發現的幾個突變存在於其他關注的變體中,可能會增加病毒感染性,例如 D614G、N501Y 和 K417N。 K417N 突變與 N501Y 一起作用完全抵銷了一些中和性抗體組的作用。值得注意的是,484位殘基在SARS-CoV-2恢復期血清的壓力下突變為多種胺基酸,該位點的突變可導致對不同恢復期血清產生免疫抗性。 484E 的多樣性意味著它位於多克隆抗體的識別「熱點」,並且在新出現的變體中發現的胺基酸變化始終表現出廣泛的免疫抗性。 Omicron 的所有三個亞系都含有 E484A 突變,進一步支持這種突變可以在一定程度上解釋觀察到的恢復期血清對中和的敏感性降低。同樣,D614G 和其他四種胺基酸序列替代:T547K、H655Y、N679K 和 P681H,可以促進刺突蛋白構型開關的剛性或柔性,使弗林蛋白酶的剪切效力增加,從而增強細胞嗜性和病毒傳播性。N764K、D796Y、N856K、Q954H、N969K 和 L981F,這些是發生在 S2 亞基中的突變。該區域涉及融合前和融合後的結構,應該通過促進刺突蛋白-ACE2之間的融合來增加傳染性。
多個研究小組最近提出了 Omicron 的另一個獨特特徵:該變體更傾向通過類似於 SARS-CoV 的胞內體途徑進入細胞,而不是由表面 TMPRSS2 蛋白酶催化形成受體依賴性合胞體。一些數據表明 Omicron 或者使用溶酶體蛋白酶(如組織蛋白酶 B/L)來切割刺突蛋白並進入宿主細胞。另有研究顯示,缺乏 TMPRSS2 蛋白酶的呼吸道細胞在 SARS-CoV 感染後肺部病變減少。 在人類細胞外植體培養的離體實驗中,Omicron 在上導氣道(鼻子、喉嚨和氣管)中的複製速度明顯快於野生型病毒株和 Delta 變體,但其在深部肺組織中的複製速度要慢十倍。 這可以解釋為什麼 Omicron 會在肺部引起較輕的症狀。
|
Omicron感染後只會造成輕症? |
答案應該是否定的。與前任的Delta 變種相比,初步數據表明 Omicron 變體似乎不太會入侵肺部,而是在上呼吸道產生中度症狀,住院及死亡風險要低得多。但世界衛生組織 (WHO) 警告不要將其描述為溫和。專家評論說,極具傳染性的 Omicron 對那些沒有接種過疫苗的人來說是致命的。迄今為止能有住院率和死亡率相對較低是由於廣泛接種疫苗,尤其是65歲以上和患有既存疾病的弱勢群體。目前仍有不確定因素影響感染者的病情。舉例來說,「腦霧(一種未定義的認知功能障礙)」、持續疲勞和呼吸困難等長期症狀的病例正在累積。在度過了Omicron急性感染的人中,大約有四分之一患有長期健康問題。科學家們試圖闡明此呼吸道病毒與認知障礙之間的機制聯繫。因此,儘管 Omicron 本質上會導致較輕的呼吸道疾病,但它會以某種方式在身體其他部位造成其他傷害。
|
我們如何應對Omicron與接下來可能的新變異病毒? |
COVID-19 不太可能被根除,但過去的社會已經學會了與疾病共存。不可避免的一件事是攜帶有害突變的新病毒株的常年出現。令人欣慰的是,大多數科學家都同意 COVID-19 大流行將結束並且該病毒將成為地方病。當它繼續在世界各地瘋狂傳播時,已經確定了許多子譜系,包括三個主要的衍生變體:BA.1、BA.2 和 BA.3。標準 Omicron 是目前最常見的子變體,現在稱為 BA.1/B.1.1.529.1。 BA.2 獲得了大部分媒體的關注,因為在丹麥、英國和印度,它似乎超過了其他子系。第三個,BA.3,全球還沒起飛,最多也就幾百例。 BA.1、BA.2 和 BA.3 彼此之間的差異與 Alpha、Beta、Gamma 和 Delta 變體之間的差異一樣大。三者之間的幾個突變也不同。我們應該認真對待所有三個子系。